Czy „genetyczne nożyczki” potrafią wyciąć raka?
Wyobraź sobie, że możemy edytować geny tak łatwo, jak poprawiamy literówki w tekście. Technika CRISPR/Cas9 to narzędzie, które może naprawiać defekty genetyczne, eliminować mutacje i umożliwić leczenie chorób nieuleczalnych. Czy genetyczne nożyczki to przyszłość medycyny?
Powiedz nam, co myślisz o OKO.press! Weź udział w krótkiej, anonimowej ankiecie.
Przejdź do ankietyLudzkie DNA jest księgą życia, pełną miliardów liter, które układają się w niezliczone historie. Każda z nich opisuje, jak wyglądamy, jak funkcjonujemy, a czasem – jak chorujemy.
Co jednak, gdybyśmy mogli te historie przepisać, poprawić literówki, słowa, zdania, a nawet całe rozdziały? Od niedawna taką możliwość daje technika CRISPR/Cas9, często określana mianem „genetycznych nożyczek”. Pozwala na precyzyjne „wycinanie” genów, a więc i potencjalne leczenie chorób, które były trudne do pokonania. To otwiera drzwi do niewyobrażalnych dotąd terapii.
Od bakterii do Nobla
Historia CRISPR/Cas9 zaczyna się nie w nowoczesnych laboratoriach, a w świecie bakterii, które wykształciły niezwykle sprytny system obronny. Mikroorganizmy te, nieustannie atakowane przez wirusy, potrzebowały sposobu na rozpoznanie i unieszkodliwienie obcego DNA. W latach 80. naukowcy odkryli w genomach bakterii powtarzające się sekwencje DNA, które na pierwszy rzut oka wydawały się pozbawione sensu. Te tajemnicze sekwencje
to tzw. CRISPR, czyli Clustered Regularly Interspaced Short Palindromic Repeats.
Przez lata te cel istnienia tych sekwencji pozostawał tajemnicą, aż w 2005 roku naukowcy ustalili, że fragmenty wirusowego DNA są przechowywane w CRISPR-ach niczym genetyczna biblioteka wroga. Kiedy wirus atakował ponownie, bakterie mogły rozpoznać obcy materiał genetyczny i zneutralizować go dzięki białku Cas (od CRISPR-associated), które precyzyjnie przecinało niepożądane DNA.
Wszystko zmieniło się w 2012 roku, gdy biochemiczka Jennifer Doudna oraz mikrobiolożka Emmanuelle Charpentier zrozumiały, że system CRISPR/Cas9 może być zastosowany nie tylko w bakteriach, ale również do precyzyjnej edycji DNA w komórkach innych organizmów.
Doudna w jednym z wywiadów powiedziała, że „odkrycie CRISPR było jak odkrycie szwajcarskiego scyzoryka genetyki – narzędzia wszechstronnego, precyzyjnego i łatwego w użyciu”. Wraz z Charpentier, Doudna opracowała sposób na „programowanie” Cas9, tak aby mogło celować w dowolne miejsce w genomie.
W 2020 roku obie naukowczynie zostały uhonorowane Nagrodą Nobla w dziedzinie chemii, a ich odkrycie zapoczątkowało nową erę w biologii molekularnej. CRISPR/Cas9, dotąd znane tylko specjalistom, stało się technologią, która rewolucjonizuje badania nad genami, medycyną i rolnictwem.
Przeczytaj także:
Precyzyjne cięcie
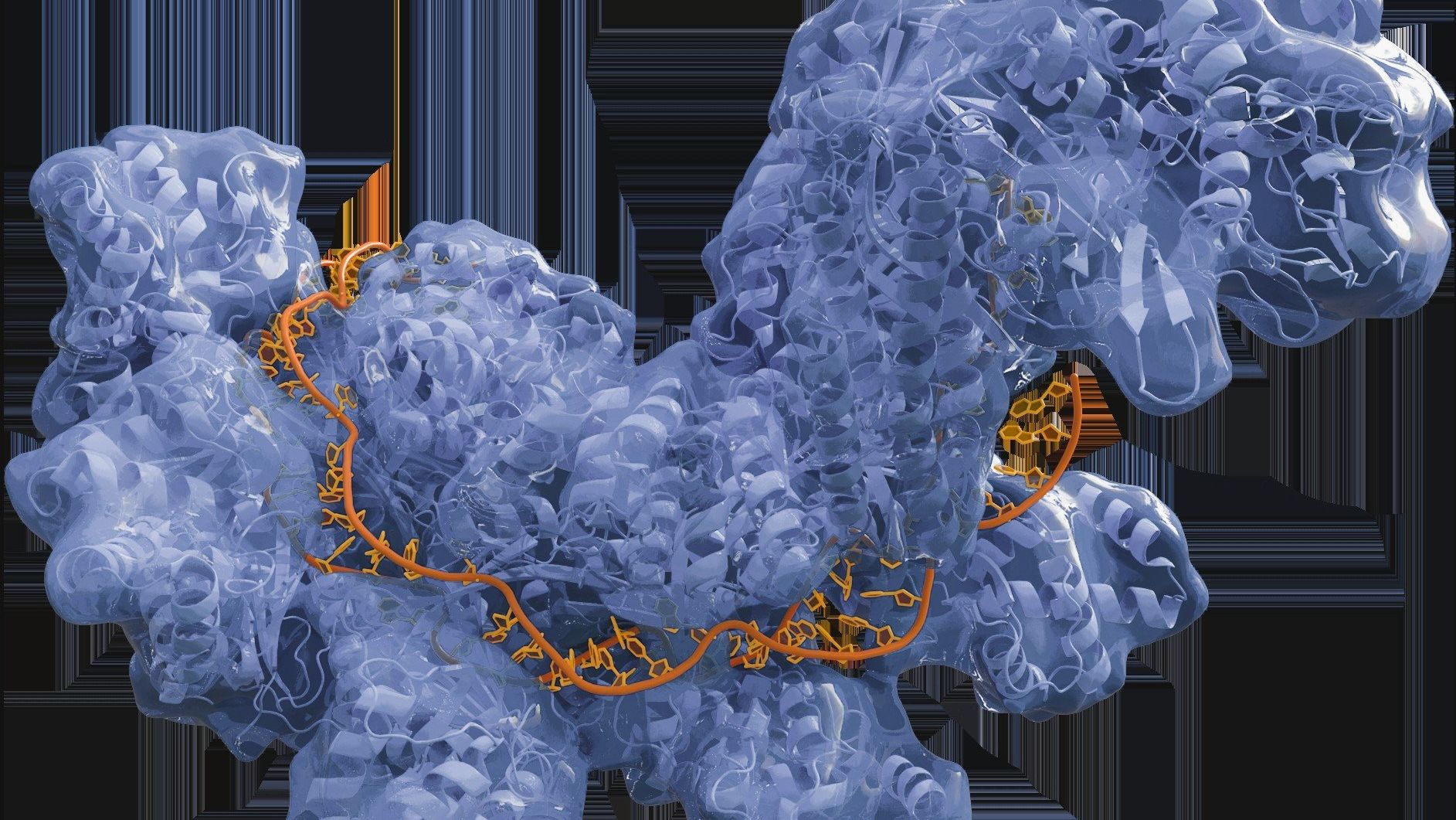
Mechanizm działania CRISPR/Cas9 można porównać do precyzyjnego „znajdź i wytnij”. Cały proces opiera się na dwóch kluczowych elementach: gRNA (guide RNA) oraz białku Cas9.
Zadaniem gRNA, odpowiednio zaprojektowanej sekwencji komplementarnej do DNA, jest wskazanie Cas9, gdzie powinno przeciąć podwójną helisę. Kiedy już do tego dojdzie, są dwie opcje. Komórka próbuje naprawić pęknięcie sama, co często prowadzi do błędów i skutkuje usunięciem nieprawidłowego genu. Można też – w sposób kontrolowany – wprowadzić nową, zdrową sekwencję, która zastępuje wadliwy fragment.
Ale CRISPR/Cas9 to coś więcej niż nożyczki do genów.
Jak zaznacza prof. Feng Zhang z MIT McGovern Institute, jeden z liderów badań nad CRISPR/Cas9: „To narzędzie pozwala nam na coś więcej niż tylko cięcie DNA – umożliwia modyfikację, poprawę i naprawę materiału genetycznego. Jesteśmy na początku nowej epoki inżynierii genetycznej”.
Co można wyleczyć dzięki CRISPR?
CRISPR/Cas9 budzi szczególną nadzieję w terapiach genetycznych chorób, które do tej pory były nieuleczalne. Chodzi o takie choroby, które mają swoje źródło w pojedynczej mutacji genetycznej – wykorzystując technikę CRISPR można się jej błyskawicznie pozbyć.
Oto kilka przykładów:
- Mukowiscydoza. To jedna z najczęstszych chorób genetycznych, wynikająca z mutacji w genie CFTR. Zaburzenie to prowadzi do gromadzenia się gęstego śluzu w płucach i przewodach trzustkowych, co powoduje poważne problemy z oddychaniem oraz trawieniem. Dzięki CRISPR badacze mogą precyzyjnie usunąć mutację i wprowadzić zdrową wersję genu CFTR, co potencjalnie może przywrócić normalną funkcję tych organów.
- Anemia sierpowata i beta-talasemia. Wywołana mutacją w genie HBB, anemia sierpowata prowadzi do deformacji czerwonych krwinek, które przyjmują kształt sierpa, co utrudnia przepływ krwi i powoduje ból oraz uszkodzenia narządów. Podobna do anemii sierpowatej jest beta-talasemia, która powoduje niedobór hemoglobiny, co prowadzi do chronicznej anemii. W badaniach prowadzonych przez firmę Vertex Pharmaceuticals pacjenci z beta-talasemią oraz anemią sierpowatą, którzy przeszli terapię CRISPR, wykazali poprawę w zakresie funkcji krwiotwórczych, a niektórzy z nich zostali uznani za wyleczonych z choroby. Pierwsze wyniki są bardzo obiecujące, pacjenci nie wymagają już regularnych transfuzji krwi, co wcześniej było niezbędne do ich przeżycia.
- Dystrofia mięśniowa Duchenne’a. Ta ciężka choroba genetyczna prowadzi do stopniowego zaniku mięśni, co jest spowodowane mutacją w genie kodującym dystrofinę – białko niezbędne do prawidłowego funkcjonowania mięśni. CRISPR umożliwia „wycięcie” wadliwej sekwencji i przywrócenie produkcji dystrofiny. Badania na modelach zwierzęcych wykazały, że zastosowanie CRISPR prowadzi do istotnego przywrócenia funkcji mięśniowych.
- Choroba Huntingtona. Neurodegeneracyjne schorzenie spowodowane powtarzalnymi sekwencjami w genie HTT, które powodują uszkodzenia komórek nerwowych i postępującą utratę funkcji poznawczych. CRISPR oferuje możliwość precyzyjnego wycięcia tych powtórzeń, co w badaniach na zwierzętach spowolniło, a nawet zatrzymało rozwój choroby. Prof. Robert Desimone z MIT zauważa: „Choroba Huntingtona to jeden z najbardziej przerażających wyroków genetycznych. CRISPR daje nam nadzieję na zahamowanie tej brutalnej degeneracji”.
- Wrodzona ślepota Lebera (LCA). To choroba dziedziczna prowadząca do degeneracji siatkówki i utraty wzroku, będąca wynikiem mutacji w genie CEP290, który prowadzi do zniszczenia fotoreceptorów w siatkówce oka. W ramach badań klinicznych firma Editas Medicine we współpracy z Allergan wykorzystała CRISPR, aby naprawić uszkodzony gen w siatkówce pacjentów. W badaniu o nazwie BRILLIANCE pacjentom podano CRISPR bezpośrednio do oka, co pozwala naprawić mutacje w miejscu ich występowania. Pierwsze wyniki badań wskazują na poprawę funkcji widzenia u niektórych pacjentów, co jest dużym przełomem, zważywszy na fakt, że LCA do tej pory była chorobą nieuleczalną.
- Choroba Tay-Sachsa. Jest wynikiem mutacji w genie HEXA, co prowadzi do gromadzenia się szkodliwych substancji w komórkach nerwowych mózgu. Naukowcy badają możliwość edycji genów przy użyciu CRISPR, aby naprawić te mutacje i powstrzymać degenerację neuronów.
- Zespół Angelmana. To rzadkie zaburzenie neurologiczne wynikające z defektu w genie UBE3A. CRISPR może zostać wykorzystane do przywrócenia funkcji tego genu, co potencjalnie może poprawić jakość życia pacjentów.
Lista chorób, które mogą być leczone przy pomocy CRISPR, stale się wydłuża. Badania nad takimi schorzeniami jak fenyloketonuria, zespół Marfana, mukopolisacharydoza typu I, wskazują na ogromny potencjał terapeutyczny tej techniki.
CRISPR jest testowane jako narzędzie do eliminacji wirusa HIV z genomu zakażonych komórek. Chociaż jest to wczesna faza badań, technologia ma potencjał do trwałego usunięcia wirusa z organizmu pacjentów, co mogłoby prowadzić do wyleczenia tej choroby.
A co z terapiami przeciwnowotworowymi? Czy CRISPR pomoże pokonać raka?
CRISPR vs. nowotwory
Technika CRISPR znalazła także zastosowanie w onkologii. Obecnie trwają liczne badania, które testują różne strategie jej wykorzystania w walce z nowotworami. CRISPR może pomóc w onkoterapii poprzez kilka kluczowych mechanizmów, takich jak modyfikacja układu odpornościowego, eliminacja genów odpowiadających za rozwój nowotworów, czy zwiększenie efektywności obecnych metod leczenia.
Jednym z najbardziej obiecujących zastosowań CRISPR w leczeniu nowotworów jest wsparcie terapii CAR-T (ang. chimeric antigen receptor T-cells). W tej terapii limfocyty T pacjenta są genetycznie modyfikowane, aby rozpoznawały specyficzne antygeny na powierzchni komórek nowotworowych, a następnie je niszczyły. CRISPR umożliwia precyzyjną modyfikację tych komórek odpornościowych, co zwiększa ich zdolność do rozpoznawania i eliminacji nowotworów.
Zespół badawczy pod kierownictwem prof. Carla June z University of Pennsylvania prowadzi pionierskie prace nad zastosowaniem CRISPR w terapii CAR-T. Jak zauważa prof. June: „CRISPR daje nam narzędzia do stworzenia superżołnierzy w naszym układzie odpornościowym, którzy mogą zniszczyć raka od środka”.
Badania kliniczne nad terapią CAR-T z wykorzystaniem CRISPR prowadzone przez zespół prof. June'a oraz firmy biotechnologiczne takie, jak Editas Medicine i Bristol Myers Squibb pokazują, że edytowane limfocyty T mogą być skuteczne w walce z różnymi rodzajami nowotworów krwi, np. szpiczakiem mnogim i ostrą białaczką limfoblastyczną. Pierwsze wyniki badań wskazują na znaczącą skuteczność tej terapii, zwłaszcza w przypadkach, gdy inne metody leczenia zawiodły.
Oprócz terapii CAR-T naukowcy testują możliwość edytowania innych rodzajów komórek układu odpornościowego, takich jak komórki NK (ang. Natural Killer), które mogą naturalnie niszczyć nawet złożone tkanki nowotworowe. Jednym z ciekawych podejść jest wyłączenie w tych komórkach tzw. genów inhibitorowych, które normalnie tłumią odpowiedź immunologiczną. Dzięki temu komórki NK stają się bardziej agresywne i skuteczniejsze w atakowaniu nowotworów, takich jak czerniak czy rak nerki.
CRISPR/Cas9 może być również stosowane do wyłączania lub edytowania genów, które są odpowiedzialne za rozwój nowotworów. Np. mutacje w genach KRAS i TP53 są związane z rozwojem różnych rodzajów nowotworów, w tym raka płuc, raka jelita grubego i raka trzustki.
Z kolei glejak wielopostaciowy, agresywny nowotwór mózgu, jest szczególnie trudny do leczenia, ponieważ tradycyjne metody, takie jak chirurgia czy radioterapia, często nie przynoszą długoterminowych efektów. Nowe badania skupiają się na użyciu CRISPR do wyciszenia genów związanych z mechanizmami naprawy DNA, które pozwalają komórkom glejaka na przetrwanie tradycyjnych onkoterapii. Dzięki temu glejak może stać się bardziej podatny na te terapie, co zwiększa szanse pacjentów na dłuższe przeżycie.
W badaniach na modelach zwierzęcych naukowcy wykazali, że edycja genów takich jak TERT (telomerase reverse transcriptase) przyczynia się do zahamowania wzrostu komórek nowotworowych wątroby.
CRISPR można użyć także do wyciszania mutacji genów EGFR i ALK, które są często obecne w raku płuc.
Przeczytaj także:
Nie ma róży bez kolców
Choć CRISPR/Cas9 jest obiecującym narzędziem, nie jest wolne od ograniczeń. Jednym z najważniejszych problemów, które muszą zostać rozwiązane, jest ryzyko tzw. off-target effects – przypadków, gdy narzędzie edytuje DNA w niewłaściwym miejscu, co może prowadzić do nieprzewidzianych mutacji i potencjalnie szkodliwych efektów. Nawet niewielkie zmiany w innych genach mogą wywołać poważne konsekwencje, szczególnie jeśli dotkną kluczowych funkcji komórki.
Innym problemem jest dostarczanie CRISPR do odpowiednich komórek w organizmie. Chociaż w laboratorium technika ta działa bardzo precyzyjnie, to w praktyce klinicznej dostarczenie CRISPR do wszystkich komórek, które wymagają edycji, jest trudne i wymaga opracowania bardziej zaawansowanych technologii nośników, np. wirusów lub nanocząstek.
Jak podkreśla dr David Liu z Broad Institute: „Jesteśmy na bardzo wczesnym etapie badań klinicznych. Mamy fantastyczne narzędzie, ale musimy nauczyć się, jak je bezpiecznie i efektywnie wykorzystywać u ludzi”.
Technika CRISPR/Cas9, mimo swojej obiecującej przyszłości, wywołuje wiele pytań etycznych. Edytowanie genomu ludzkiego, zwłaszcza na poziomie zarodkowym, budzi kontrowersje. Istnieje ryzyko, że CRISPR zostanie wykorzystany do tzw. projektowania dzieci, czyli tworzenia ludzi z wybranymi cechami fizycznymi czy intelektualnymi.
Czy mamy prawo wkraczać w naturalny kod życia na tak głębokim poziomie?
W 2018 r. chiński naukowiec He Jiankui ogłosił, że stworzył pierwsze genetycznie zmodyfikowane dzieci za pomocą CRISPR, co wywołało falę krytyki i potępienia ze strony środowiska naukowego. Działania te ukazały pilną potrzebę wprowadzenia globalnych regulacji dotyczących wykorzystania CRISPR.
Jak zauważyła prof. Jennifer Doudna: „Mamy w rękach niezwykle potężne narzędzie. Musimy jednak pamiętać, że wielka moc niesie ze sobą wielką odpowiedzialność. Naszym zadaniem jest zapewnienie, że CRISPR będzie wykorzystywane wyłącznie dla dobra ludzkości”.
Co dalej?
Z każdym kolejnym rokiem rozwój CRISPR staje się coraz bardziej dynamiczny, a naukowcy pracują nad ulepszaniem tej techniki, aby stała się jeszcze precyzyjniejsza i bezpieczniejsza. Pojawiają się już nowe warianty CRISPR, takie jak CRISPR/Cas12 i CRISPR/Cas13, które oferują różne możliwości edycji nie tylko DNA, ale także RNA.
Edytowanie RNA daje nadzieję na leczenie chorób, które wynikają z problemów na poziomie translacji białek, takich jak niektóre choroby neurodegeneracyjne.
Dodatkowo rozwijane są nowe metody edycji epigenomu, czyli kontrolowania ekspresji genów bez bezpośredniego zmieniania sekwencji DNA. Te podejścia mogą okazać się kluczowe w leczeniu chorób, w których geny działają nieprawidłowo, ale ich sekwencje są nienaruszone.
Inżynieria genetyczna zmierza także w stronę tzw. genetycznych napraw bez mutacji, czyli naprawiania błędów w DNA bez wprowadzania cięć i nowych sekwencji, co znacznie zmniejsza ryzyko mutacji off-target. Metoda ta, zwana prime editing, została opracowana przez dr. Davida Liu i jego zespół, a jej zastosowanie może jeszcze bardziej zwiększyć bezpieczeństwo edytowania genów.
Prawda czy fałsz?
Technika CRISPR/CAS9, czyli tak zwane genetyczne nożyczki, umożliwi wkrótce leczenie chorób nowotworowych
Stworzony zgodnie z międzynarodowymi zasadami weryfikacji faktów.
CRISPR/Cas9 to nie tylko technologia – to symbol naszych możliwości w przekształcaniu biologii, a nawet samego życia. Otworzyliśmy drzwi do świata, w którym możemy nie tylko zrozumieć kod genetyczny, ale go naprawić i, być może, tworzyć nowe wersje życia.
To, co jeszcze niedawno wydawało się być marzeniem science fiction, dziś staje się rzeczywistością w laboratoriach na całym świecie.
Czy jesteśmy gotowi na przyszłość, w której będziemy mieć władzę nad własnym genomem? Jak daleko powinniśmy się posunąć w modyfikowaniu życia?
Te pytania będą towarzyszyć nam na każdym kroku tej fascynującej podróży. Ta przyszłość jest pełna nieskończonych możliwości, ale też wielkich wyzwań. Wyobraźmy sobie świat, w którym genetyczne choroby nie będą już wyrokami, a jedynie problemami do rozwiązania – to przyszłość, którą CRISPR właśnie zaczyna pisać.
Biolog, dziennikarz popularnonaukowy, redaktor naukowy Międzynarodowego Centrum Badań Oka (ICTER). Autor blisko 10 000 tekstów popularnonaukowych w portalu Interia, ponad 50 publikacji w papierowych wydaniach magazynów „Focus", „Wiedza i Życie" i „Świat Wiedzy". Obecnie publikuje teksty na Focus.pl.
Biolog, dziennikarz popularnonaukowy, redaktor naukowy Międzynarodowego Centrum Badań Oka (ICTER). Autor blisko 10 000 tekstów popularnonaukowych w portalu Interia, ponad 50 publikacji w papierowych wydaniach magazynów „Focus", „Wiedza i Życie" i „Świat Wiedzy". Obecnie publikuje teksty na Focus.pl.
Komentarze