W poszukiwaniu części zamiennych. O najnowszych próbach wszczepiania ludziom świńskich nerek i serc
Pobieranie narządów od świni budzi w pani wątpliwości etyczne? – pytam prof. Magdalenę Durlik. „Ale wie pan, cel uświęca środki” – słyszę w odpowiedzi. „Wątpliwości etyczne budzi u mnie raczej pytanie, czy my nie robimy krzywdy temu biorcy”
Powiedz nam, co myślisz o OKO.press! Weź udział w krótkiej, anonimowej ankiecie.
Przejdź do ankiety- Przeszczep zmodyfikowanej genetycznie świńskiej nerki to przełomowe wydarzenie w medycynie;
- przeszczepów od żywego dawcy jest wciąż zbyt mało, a zapotrzebowanie na nerki rośnie;
- w medycynie nie mamy innych możliwości rozwoju badań naukowych niż eksperymenty na zwierzętach;
- jeśli się okaże, że po 2-3 latach świńska nerka przestaje funkcjonować, nikt nie będzie w to inwestował.
O perspektywach ksenoprzeszczepów, czyli przeszczepów międzygatunkowych, rozmawiamy z prof. Magdaleną Durlik, kierowniczką Kliniki Transplantologii, Immunologii, Nefrologii i Chorób Wewnętrznych Warszawskiego Uniwersytetu Medycznego.
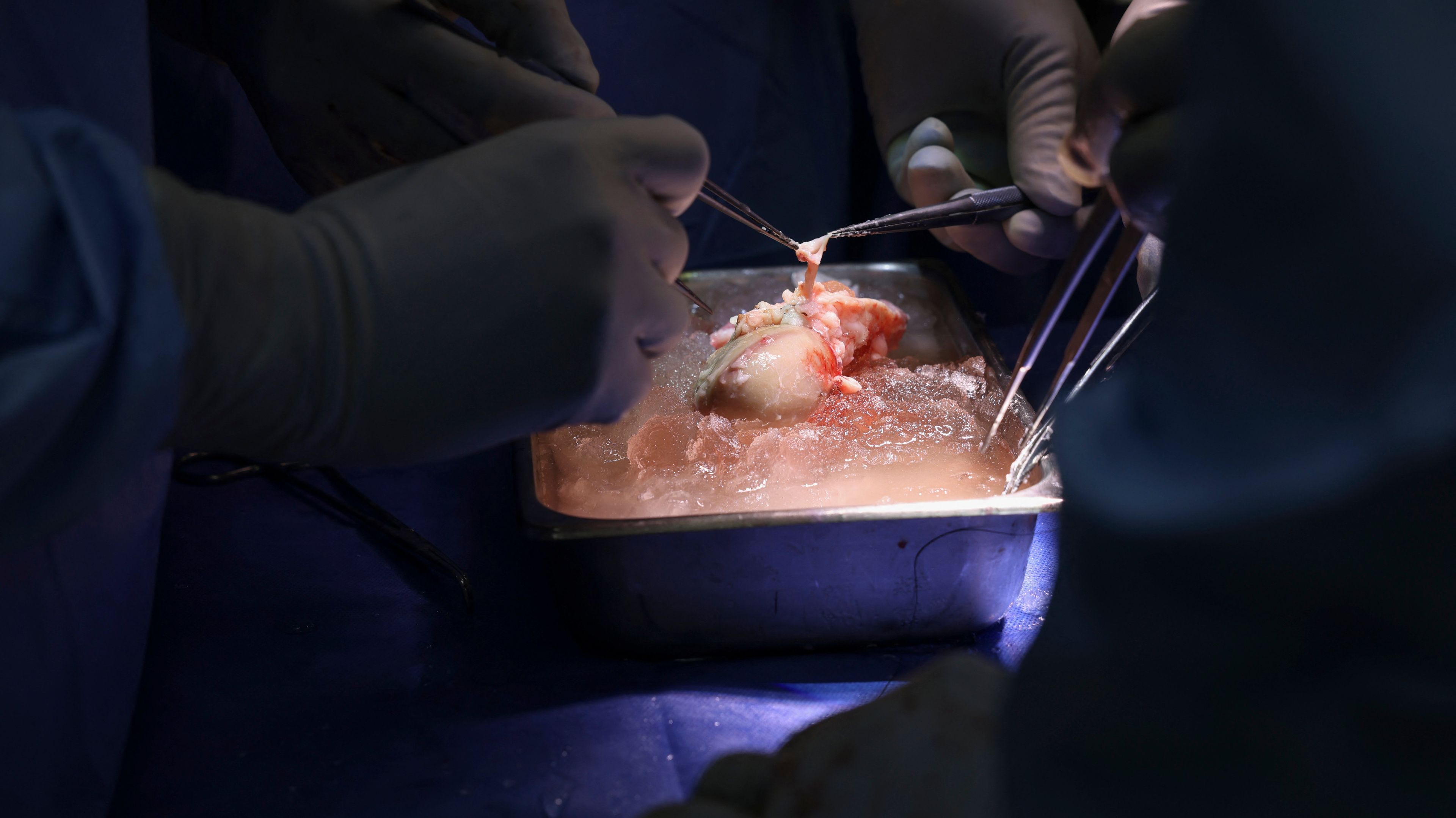
Sławomir Zagórski, OKO.press: W połowie marca 2024 w bostońskim Massachusetts General Hospital 62-letnimu pacjentowi ze schyłkową niewydolnością nerek wszczepiono nerkę świni. Narząd podjął pracę. Mężczyzna dość szybko opuścił szpital. Lekarze liczyli, że nerka wytrzyma co najmniej dwa lata.
Niestety, dwa miesiące po operacji chory zmarł. Zespół, który go operował, zapewnił, że przyczyną zgonu najprawdopodobniej nie był przeszczep. Żyje za to pacjentka, której świńską nerkę przeszczepiono w kwietniu w Nowym Jorku. Pacjentce tej wszczepiono w dodatku nieco wcześniej urządzenie do mechanicznego wspomagania czynności serca.
Czy pani zdaniem bostoński zabieg można nazwać przełomowym?
Prof. Magdalena Durlik*: Tak. Patrząc na historię i przyszłość transplantologii, ocenia się, że przeszczepy odzwierzęce będą wykorzystywane w przyszłości prawdopodobnie coraz częściej.
Aczkolwiek mówi się też o dużych kosztach. Bo proszę pamiętać, że nie była to zwykła świnia, tylko odpowiednio zmodyfikowana genetycznie. Usunięto jej trzy świnskie geny, dodano też siedem ludzkich, by zmniejszyć ryzyko odrzucania przeszczepu.
Takie zwierzę musiało być ponadto hodowane w dość sterylnych warunkach, by nie zakaziło się różnymi wirusami i innymi drobnoustrojami, które potem mogło przekazać biorcy. Naukowcy dodatkowo inaktywowali metodami inżynierii genetycznej potencjalne groźne dla człowieka świńskie retrowirusy.
Więc generalnie koszty przełamania bariery od tego gatunku są bardzo wysokie.
Główny problem ksenoprzeszczepów
Ksenoprzeszczepy, czyli przeszczepy międzygatunkowe, mają już długą historię. Dość wspomnieć o próbie przeszczepienia serca świni człowiekowi podjętej przez prof. Zbigniewa Religę 35 lat temu.
Rzeczywiście, tych prób było sporo. Wspomnę o dwóch niedawnych.
W ubiegłym roku przeszczepiono dwukrotnie świńskie nerki ludziom, których uznano za zmarłych, ponieważ umarł ich pień mózgu. Zabiegi przeprowadzono za zgodą rodziny i komisji etycznej. W jednym przypadku usunięto obie własne nerki zmarłemu biorcy i na ich miejsce włożono świńskie narządy. W drugim przeszczepiono świńską nerkę człowiekowi na udo, po to, by można ją było obserwować.
Przeczytaj także:
To oczywiście były tylko eksperymenty, które w pewnym momencie przerywano. Chodziło o to, by sprawdzić, czy odpowiednia modyfikacja genetyczna świni i równoczesne podawanie biorcy leków immunosupresyjnych zminimalizują ryzyko odrzucania.
Bo to jest naturalnie głównym problemem ksenoprzeszczepów. Świńska nerka na swoim śródbłonku posiada specyficzne antygeny, których nie ma ludzki śródbłonek. W trakcie przebiegu ewolucji antygen ów został przez nas utracony. I po to, by w ogóle myśleć o wszczepieniu człowiekowi świńskiej nerki, należy w pierwszym rzędzie zmodyfikować zwierzę pod tym kątem.
Zalety świńskich narządów
Może lepiej byłoby szukać organów u zwierząt bliższych genetycznie człowiekowi?
Próbowano też tego rozwiązania, zwłaszcza na początku.
Ale takie próby są znacznie kosztowniejsze.
Małpy naczelne wolno rosną, późno dojrzewają, są mało płodne. Ponadto ich organy są dla nas trochę za małe.
A świnie nie dość, że dużo tańsze, to i wielkością i – jak się okazuje – fizjologią, bardziej do nas pasują. Ich mocz ma podobną osmolarność [oblicza się ją, podając liczbę moli substancji osmotycznie czynnej w 1 kg rozpuszczalnika, w tym wypadku wody]. Przesączanie kłębuszkowe i przepływ krwi przez nerki też wygląda podobnie.
Do tego świnie się szybciej hoduje, szybciej się rozmnażają, są bardziej dostępne, więc dlatego uwaga naukowców zajmujących się ksenoprzeszczepami skupia się właśnie na nich.
Jest jeszcze jeden argument przemawiający za użyciem tych zwierząt – dystans filogenetyczny. Naczelne są zbyt blisko spokrewnione z człowiekiem i zakażają się podobnymi wirusami. Natomiast świnie powinny zakażać się takimi drobnoustrojami, które teoretycznie nie grożą człowiekowi. Ale tak do końca niestety nie jest.
W 2022 i 2023 podjęto dwie próby przeszczepienia człowiekowi świńskiego serca. Narządy podjęły pracę, nie obserwowano ostrego odrzucania. Niemniej jednak biorcy po kilku tygodniach zmarli. Podejrzewano, że przyczyną były właśnie infekcje wywołane obecnością świńskich wirusów.
Wracając do pańskiego pytania o przełom, powtarzam, że jest to przełom, aczkolwiek niezwykle kosztowny.
Ponieważ jednak narządów do transplantacji bardzo brakuje [lista oczekujących na nerkę w Stanach liczy 90 tys.], trzeba eksplorować i tę drogę.
Z drugiej strony zawsze powtarzam, że my w Polsce mamy duże możliwości pozyskiwania narządów od zmarłych dawców, tylko nie potrafimy tego wykorzystać. Nasz system zgłaszalności dawców pozostawia wiele do życzenia. Hiszpania potrafi mieć 50 zmarłych dawców na milion mieszkańców, a my mamy 14.
Powiedzmy jeszcze, że ksenotransplantacje to nie jedyna droga poszukiwania alternatyw dla narządów pobranych od żywych lub zmarłych dawców.
Od lat próbuje się hodować narządy od podstaw. Tyle że to jeszcze trudniejszy z punktu widzenia naukowego problem. Na razie te hodowane nereczki są bardzo małe i nie nadają się do niczego. Ale co będzie jutro?
69 genetycznych modyfikacji
Świnia, od której pobrano nerkę wszczepioną w tym roku w Bostonie, została poddana 69. modyfikacjom genetycznym. 10 z nich było związanych z hamowaniem reakcji ludzkiego układu odpornościowego na przeszczep. Reszta z potencjalnymi infekcjami wirusowymi.
Pani zdaniem genetycy zrobili już w tej sprawie wszystko, co trzeba? Czy należy dalej świnie w tym celu „uczłowieczać”?
Trudno mi odpowiedzieć na to pytanie, ponieważ jestem klinicystą, nie genetykiem.
Sądzę jednak, że zawsze będą nowe możliwości modyfikacji genetycznych. Że to nie jest jeszcze doskonałość. Może na tym etapie rozwoju naszej wiedzy medycznej i genetycznej to jest wystarczające. Ale medycyna cały czas idzie do przodu. Odkrywamy ciągle nowe rzeczy, ciągle wszystko modyfikujemy.
Możemy powiedzieć, że skoro nerka funkcjonuje, to jest to w porządku, aczkolwiek poczekajmy rok czy dwa [bostoński pacjent zmarł ostatecznie po dwóch miesiącach].
Nerki pobrane od zmarłego ludzkiego dawcy funkcjonują przeciętnie kilkanaście lat. Ale są tacy biorcy, którzy noszą nerkę lat 20.
Moja najstarsza biorczyni nosi nerkę 39 lat.
Więc biorąc pod uwagę olbrzymie koszty hodowania tych świń i procedur genetycznych (co oczywiście z czasem powinno tanieć), a świńska nerka będzie np. funkcjonować rok czy dwa, to i tak nie będzie to moim zdaniem powszechnie stosowana procedura.
Immunogenność nerek, wątroby, serc
Chciałem jeszcze zapytać o immunogenność, innymi słowy o wywoływanie reakcji odrzucenia obcego narządu. Jak pod względem wygląda nerka na tle innych przeszczepianych narządów?
Nerka jest immunogennym narządem, który jest dość łatwo odrzucany.
Inaczej sytuacja wygląda np. z wątrobą, która nie jest specjalnie immunogenna. Bardziej immunogenne niż wątroba są także serce i płuca.
W Polsce nerka jest jedynym narządem, przy przeszczepieniu którego obowiązuje dobór immunologiczny. Chodzi o tzw. typowanie tkankowe, czyli oznaczenie antygenów HLA dawcy i biorcy. Przeprowadzamy także biologiczną próbę krzyżową pomiędzy limfocytami dawcy a surowicą biorcy.
W przypadku innych narządów takich wymogów nie ma. Ale także czas nie pozwala na typowanie tkankowe (8-10 godzin) w przypadku serca, czy płuca, bo te narządy w przeciwieństwie do nerek muszą być szybko wszczepione.
Więc nerka jest rzeczywiście immunogenna. I dlatego staramy się zmniejszyć ryzyko odrzucania zarówno doborem immunologicznym, jak i immunosupresją, czyli podawaniem leków hamujących działanie układu odpornościowego.
Leki po przeszczepie
Czy wszczepiając człowiekowi nerkę świni, trzeba stosować inną, silniejszą immunosupresję niż wtedy, gdy stosuje się ludzki narząd?
Wykazano, że standardowa immunosupresja jest skuteczna, ale dodatkowo konieczne jest zastosowanie leków hamujących aktywację układu dopełniacza i powstawanie kompleksu atakującego błonę, który uszkadza śródbłonek i powoduje rozwój mikroangiopatii zakrzepowej.
W komunikacie z bostońskiego szpitala czytam, że ich pacjent dostał dwa leki immunosupresyjne – tegoprubart i rawulizumab.
To te dodatkowe. Eksperymentalny lek o nazwie tegoprubart, podawany co trzy tygodnie za pomocą kroplówki, blokuje sygnał kostymulacji między limfocytami T i B, co pomaga stłumić odpowiedź immunologiczną skierowaną przeciwko narządowi dawcy.
A rawulizumab to przeciwciało monoklonalne przeciwko fragmentowi C5 dopełniacza, które zapobiega rozwojowi wykrzepiania wewnątrznaczyniowego i w konsekwencji martwicy przeszczepu.
W przypadku, o którym rozmawiamy, amerykański Urząd ds. Żywności i Leków zaakceptował to leczenie jako eksperymentalne. Akceptację było łatwiej uzyskać także z tego względu, że w przypadku przeszczepu nerki zawsze jest możliwość odwrotu. Pacjent może bowiem wrócić na dializy.
Rzeczywiście w przypadku przeszczepiania nerki jest taki komfort. Z sercem jest już gorzej.
Zdarza się jednak, że wyczerpują się możliwości dostępu naczyniowego do hemodializy i nie jest także możliwa dializa otrzewnowa. Wówczas przeszczepienie nerki staje się zabiegiem ratującym życie.
Życie na dializach na pół gwizdka
Jak to jest z tym wracaniem? Prawdę mówiąc, nie do końca rozumiem, dlaczego, skoro udało się zrobić tak dobre sztuczne nerki i można się dializować latami, w którymś momencie przeszczep staje się jedynym ratunkiem. Co więcej, trzeba go zrobić odpowiednio wcześnie, gdy pacjent nie jest jeszcze aż tak bardzo chory.
Proszę pamiętać, że sztuczna nerka nie zastępuje czynności nerki przeszczepionej. Nigdy nie osiągnie tak dużego przesączania kłębuszkowego. Sztuczna nerka nie wydziela hormonów, nie produkuje witaminy D i innych potrzebnych substancji.
Życie na dializach to życie na pół gwizdka, nie mówiąc o jego komforcie.
Każdy rok dializ je skraca i choć przeżycie pacjentów na dializach może być długie, statystycznie żyją oni znacznie krócej niż chorzy po przeszczepieniu. I nie mamy wątpliwości, że im wcześniej przeszczepimy nerkę, tym wyniki są lepsze.
Najlepiej zrobić to jeszcze przed rozpoczęciem dializ, czyli wykonać tzw. przeszczepienie wyprzedzające. Wtedy uzyskujemy najlepsze wyniki przeżycia pacjenta i przeszczepu. Dodajmy, przeżycia pacjenta w dobrym stanie.
Dializa nie hamuje bowiem progresji powikłań sercowo-naczyniowych, nie zapobiega miażdżycy, nie hamuje powikłań kostnych, nie znosi niedokrwistości.
Zatem – powtórzę – najlepsze wyniki otrzymuje się, gdy chory dojrzewa już do dializ, ale jeszcze nie zaczął się dializować. A jeżeli do tego ma żywego dawcę, to już w ogóle super.
Mało przeszczepów od żywych dawców
Pamiętam, jak rozmawiałem z panią wiele lat temu i narzekałem, że w Polsce mamy tak mało żywych dawców w porównaniu np. ze Skandynawią, I wtedy odpowiedziała mi pani, że przy decyzji o oddaniu własnej nerki, trzeba jednak brać pod uwagę ryzyko, jakie to niesie dla dawcy. Nie każdy może nim być.
Ryzyko naturalnie nadal istnieje, choć poprawiły się techniki. Dziś nerki się pobiera laparoskopowo. Dawcy szybko wychodzą ze szpitala. Nie mają żadnych dużych ran.
W Polsce w tej chwili odsetek przeszczepień nerek od żywych dawców wynosi 5-7 proc., podczas, gdy w Unii Europejskiej średnio 16 proc.
A na świecie 38 proc., bo do statystyk wchodzi Azja, gdzie nie przeszczepia się prawie w ogóle narządów pobranych od zmarłego dawcy.
Dodajmy, że w Polsce liczba przeszczepień od żywego dawcy rośnie.
Ale jesteśmy też bardzo restrykcyjni i bardzo wnikliwie badamy potencjalnego, żywego dawcę, wykrywając mu czasami przy okazji różne choroby.
Do jakiego wieku można być dawcą?
Tu decyduje nie wiek, tylko jakość narządu. Bo można być pięćdziesięciolatkiem i mieć np. bardzo zaawansowaną miażdżycę.
O jakości nerki świadczy m.in. wynik badania przesączania kłębuszkowego, ogólna ocena moczu, ocena wielkości nerek w USG, itd.
Podobnie, jeśli chodzi o biorcę, wiek metrykalny nie ma tu znaczenia.
Nasz najstarszy biorca miał 80 lat i był bardzo sprawny fizycznie.
Cel uświęca środki
Czy pobieranie narządów od świni budzi w pani wątpliwości etyczne? Obrońcy zwierząt z pewnością nie są zachwyceni tą techniką.
Ale wie pan, cel uświęca środki.
Raczej budzi we mnie wątpliwości etyczne pytanie, czy my nie robimy krzywdy temu biorcy. No bo jeżeli on się może dializować i czekać na przeszczep nerki od zmarłego dawcy, to wcale nie musi poddawać się tak dużemu eksperymentowi, który nie wiadomo, jak się skończy. Nie wiadomo, czy on nie straci zaraz tej nerki albo nie złapie jakiejś innej choroby.
Więc tu jest taka kwestia, że dajemy człowiekowi coś, co jeszcze nie jest przez nas wystarczająco dobrze poznane. Nie wiem na przykład, na jakiej podstawie zgodził się nasz bostoński pacjent.
Uznał, że ratuje nie tylko siebie, ale przysłuży się także nauce, dając nadzieję tysiącom osób potrzebującym przeszczepu.
To nie był zresztą jego pierwszy przeszczep. W 2018 wszczepiono mu ludzką nerkę, która po pięciu latach przestała funkcjonować. I wtedy lekarze zaproponowali mu świński narząd.
Ale mógł czekać na drugą, trzecią ludzką nerkę.
To pełna szacunku, odważna decyzja. Ktoś zawsze musi być pierwszy.
Zaraz przypomina mi się książka Jürgena Thorwalda „Pacjenci”.
Nie wiem, jak to będzie w przyszłości. Czy ludzie będą chcieli mieć świńskie nerki, bo – jak mówiliśmy – zawsze można skorzystać, choćby przejściowo z dializoterapii.
Może chorzy na serce prędzej będą się godzić na przeszczep odzwierzęcy, bo tam alternatywy nie ma.
Wracając do problemów etycznych, to nie słyszałem, żeby ktoś miał wątpliwości co do stosowanych coraz częściej zwierzęcych zastawek. A serce czy nerka to już brzmi zupełnie inaczej.
Cała nauka powstaje w ten sposób, że robi się eksperymenty na szczurach, myszach, królikach. Ja też – przyznaję – robiłam doktorat na psach. Nie mamy innych możliwości prowadzenia badań naukowych i postępu w medycynie.
Ślepa uliczka?
Spróbujemy na koniec pofantazjować jeszcze o przyszłości ksenoprzeszczepów. Pani zdaniem okaże się, że to raczej ślepa uliczka medycyny, czy też bardziej przemawia do pani wizja masowych hodowli uczłowieczonych świń jako źródeł narządów na wymianę?
Trudno powiedzieć.
Uliczka nie wydaje mi się ślepa, choć ksenoprzeszczepy to na razie coś wspomagającego i bardzo kosztownego. Ale Amerykanie są bogaci, a techniki modyfikacji genetycznej stwarzają nowe możliwości i powinny tanieć.
Ksenoprzeszczepy – te od naczelnych – już raz się załamały. Teraz nowe nadzieje stworzyła inżynieria genetyczna.
Na razie jest jeszcze bardzo wcześnie. Czytamy o pojedynczych przypadkach wszczepiania świńskich serc czy nerek. Jeżeli okaże się, że po 2-3 latach świńska nerka przestaje funkcjonować, nikt – jak mówiłam – nie będzie w to inwestował.
Może będziemy hodować nerki z komórek macierzystych. Niektórzy już próbują. Wielokrotnie słyszymy, że za 10 lat będziemy drukować nerki w drukarce 3D.
Jednego jesteśmy pewni: popyt na przeszczepy będzie rósł, a nie malał.
*Prof. Magdalena Durlik, kierowniczka Kliniki Transplantologii, Immunologii, Nefrologii i Chorób Wewnętrznych Warszawskiego Uniwersytetu Medycznego.
Autorka i współautorka ponad 600 publikacji naukowych. Lekarka mająca ponad 40-letnie doświadczenie w kwalifikacji biorców do transplantacji nerki od zmarłego i żywego dawcy i przewlekłej opiece nad biorcami nerki, wątroby i trzustki.
„NIEDZIELA CIĘ ZASKOCZY„ to cykl OKO.press na najspokojniejszy dzień tygodnia. Chcemy zaoferować naszym Czytelniczkom i Czytelnikom „pożywienie dla myśli” – analizy, wywiady, reportaże i multimedia, które pokazują znane tematy z innej strony, wytrącają nasze myślenie z utartych ścieżek, zaskakują właśnie.
Biolog, dziennikarz. Zrobił doktorat na UW, uczył biologii studentów w Algierii. 20 lat spędził w „Gazecie Wyborczej”. Współzakładał tam dział nauki i wypromował wielu dziennikarzy naukowych. Pracował też m.in. w Ambasadzie RP w Waszyngtonie, zajmując się współpracą naukową i kulturalną między Stanami a Polską. W OKO.press pisze głównie o systemie ochrony zdrowia.
Biolog, dziennikarz. Zrobił doktorat na UW, uczył biologii studentów w Algierii. 20 lat spędził w „Gazecie Wyborczej”. Współzakładał tam dział nauki i wypromował wielu dziennikarzy naukowych. Pracował też m.in. w Ambasadzie RP w Waszyngtonie, zajmując się współpracą naukową i kulturalną między Stanami a Polską. W OKO.press pisze głównie o systemie ochrony zdrowia.
Komentarze